| Ocorre por atração eletrostática. O metal cede elétrons e o ametal recebe elétrons. Existe grande diferença de eletronegatividade entre os elementos. |
| São sempre iônicas as ligações entre os grupos: 1 + 17, 1 + 16, 2 + 17 e 2 + 16. |
| Exemplos mais comuns: NaCl, CsCl, CaO, MgCl2, CaS, Na2SO4, NaHCO3, Na2CO3. |
Propriedades dos compostos iônicos:
|
Cristal iônico - atração eletrostática entre os íons:
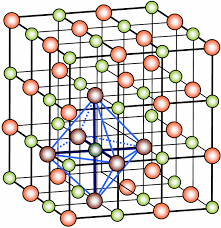
Elaboração do Prof. Paulo Silva
