Anaxágoras (499-442 aC):
"O universo é provavelmente formado por partículas minúsculas
Leucipo de Mileto (450-370 aC):
conceito semelhante ao de Anaxágoras.
Demócrito de Abdera (460-370 aC):
Os átomos (indivisíveis), são infinitos em quantidade e qualidade e
indestrutíveis. Átomos adotam forma, modo e condições de produzir grande
variedade de materiais diferentes. Sendo uniforme e sem diferenças
qualitativas entre os elementos, porque os átomos são idênticos.
Lucretius (99-55 aC):
postulou que o fundamento central do universo gira em torno dos átomos.
Heron (S. III dC): "Os gases são compostos de partículas."
John Dalton (1803):
a) todos os elementos são compostos de partículas indivisíveis e microscópicas chamados átomos.
b) o universo, é formado por um grande número de substâncias, é o resultado da combinação de átomos.
c) os átomos do mesmo elemento são idênticos uns aos outros em termos de sua massa, tamanho e forma, os átomos de diferentes elementos são diferentes.
William Crookes (1832-1919):
Através de experimentos com descargas elétricas em tubos de
vácuo, ele descobriu os raios catódicos, com carga elétrica negativa.
Robert Andrew Millikan (1868-1953):
Determina o valor da massa dos elétrons e confirma a existência de átomos
como constituintes da matéria. Mas também mostra que os átomos não são
indivisíveis.
Dmitri Ivanovich Mendeleiev (1834-1907):
Em 1869 uma organização desenvolve os diferentes elementos químicos
conhecidos com base em seus conhecimentos de "Valência" (combinação de
capacidades). Linhas na horizontal e vertical mostram as semelhanças no
comportamento e, a ordem crescente das
suas massas atômicas. Atualmente, os elementos são ordenados na tabela
em ordem crescente do seu número atômico, ou seja, o número de prótons
que possuem em seus núcleos.
Eugen Goldstein (1850-1930):
Identificou os raios canal como sendo compostos de partículas positivas os
chamados "prótons".
James Chadwick (1891-1985):
Evidencia a existência de nêutrons, com massa semelhante a do proton, mas
sem carga elétrica.
Joseph John Thomson (1856-1940):
Chama os raios catódicos de "elétrons" e determina sua relação
carga/massa. Delineia o átomo como uma massa carregada positivamente
dentro do qual as partículas negativas estão incrustradas em número
suficiente para neutralizar a matéria.
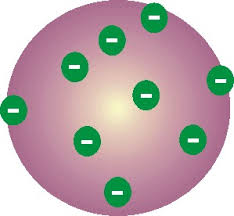
Ernest Rutherford (1871-1937):
Desenvolve a idéia de um núcleo atômico constituído de prótons positivos
com elétrons negativos girando em torno dele.

Niels Bohr (1885-1962):
Nos átomos os elétrons não giram ao redor do núcleo em qualquer
lugar. Estes níveis são K, L, M, N, O, P e Q (anteriormente), ou 1, 2, 3, 4, 5,
6 e 7 (atualmente). A energia de cada um desses níveis é constante
(quantizada), de modo que ele sempre será um número exato
de comprimentos de onda. Enquanto um elétron está em um mesmo nível
ele não irradia energia.
Quando um átomo absorve uma quantidade suficiente de energia, pode
saltar para uma camada exterior . Quando ele voltar ao seu estado inicial
emite uma quantidade de energia correspondente à diferença entre essas
camadas.

Arnold Sommerfeld:
descobre que os níveis são compostos subníveis (s, p, d, f) e considera não
órbitas circulares, mas elípticas.
Werner Heisenberg (1901-1976):
Divulga o seu "princípio incerteza", que pode ser expressa por dizer que você
“não se pode saber exatamente, simultaneamente, a posição e a velocidade
do elétron”. Se determinarmos sua posição não saberemos a medida da sua
velocidade. Se determinarmos sua velocidade, não podemos determinar a
sua posição.
Erwin Schrödinger (1887-1961):
Desenvolve o "modelo quântico do átomo" ou "modelo probabilístico",
colocando uma equação matemática (equação de onda) para o cálculo da
probabilidade de encontrar um elétron girando em uma uma região do
espaço denominada "orbital atômico".
Elaboração: Prof. Paulo Silva
